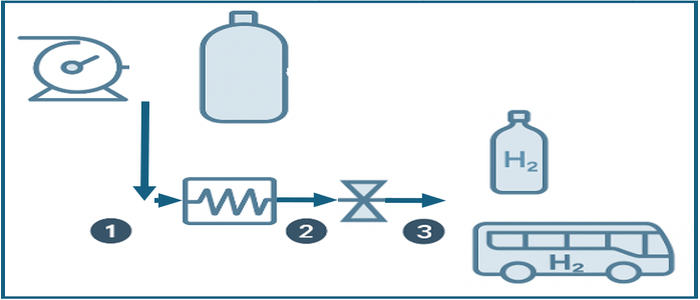
Lo único necesario para poder conocer el estado final de la recarga de hidrógeno de un recipiente, es conocer las condiciones de presión y temperatura a su entrada, y aplicar el primer principio de la termodinámica. Esto quiere decir que todos los fenómenos aguas arriba, como aumento de temperaturas por expansiones en válvulas, pérdidas de línea, etc... no tendrán impacto en la temperatura alcanzada en el recipiente recargado. Vamos a verlo.
En los procesos de recarga de hidrógeno es común lidiar con procesos de expansión y compresión, al igual que con otras tipologías de gases. Con algunas particularidades como el aumento de temperatura en las válvulas de expansión, en contra de la mayoría de los gases.
El esquema habitual en estos procesos de recarga puede ser:
- Una carga directa desde un compresor al recipiente a presión.
- Una carga por trasiego de presiones, desde recipientes de mayor presión a menos presión. En este caso, nos encontramos con procesos de expansión de mayor envergadura que en el primero.
Es conocido que el proceso de recarga de H2 produce calor, y este debe ser controlado. Pero, si primero el hidrógeno en la expansión produce aumentos de temperatura ¿produce luego frío durante la compresión en el recipiente? En caso contrario, en qué parte del proceso se produce más calor, ¿en el proceso de expansión en válvulas, o en el proceso de compresión dentro del recipiente?
Todas estas preguntas podemos resolverlas con la aplicación del primer principio de la termodinámica.
Aumento de temperatura en las válvulas limitadoras de presión - Expansión
En cualquier proceso de expansión (proceso de pérdida de presión repentina de un gas) se produce un cambio en las condiciones de presión y temperatura. Esto es por ejemplo, para una expansión de gas natural, en la que hacemos descender drásticamente la presión, se aprecia que el mismo gas sufre una pérdida de temperatura repentina. Por el contrario, tanto el helio como el hidrógeno, son los únicos gases que en condiciones atmosféricas producen un aumento de temperatura en el mismo proceso.
La termodinámica recoge la descripción de este fenómeno como efecto Joule-Thompson (conoce más sobre este fenómeno aquí Efecto Joule-Thompson), donde el gas conserva su energía suponiendo la expansión como un cambio brusco y sin transferencia de calor con el exterior. Esto quiere decir que, aumente o disminuya la temperatura del gas en la expansión, no tendrá ningún efecto sobre la energía que vaya a ingresar en el recipiente a presión. Y es la energía de entrada al recipiente, la única responsable que marcará la temperatura final del recipiente recargado.
Hablando en términos de energía, y no de temperatura - Entalpía y Energía Interna
Esto anterior, se puede ver de forma más intuitiva hablando de la energía del sistema, representado en este caso por la entalpía o la energía interna. Ambas nos dicen la energía en un sistema (volumen de gas), y la magnitud de ambos viene definida por el par de presión y temperatura. Hablamos de entalpía en procesos a presión constante, y de energía interna en procesos a volumen constante, pero ambos son expresiones que nos vienen a describir simplemente el nivel de energía. Si tenemos entonces dos de estos tres términos (temperatura, presión y entalpía o energía interna), podemos hallar el tercero.
Por tanto, para conocer la temperatura final del recipiente recargado debemos de hacer un balance de energía, donde será imprescindible saber la entalpía que entra. Y esta entalpía, observando el diagrama, será la misma en el punto 1 que en el punto 3 (imaginando que el intercambiador no esta jugando ningún papel, y el punto 2 es igual al 1). Como hemos expresado anteriormente, el proceso de expansión no intercambia energía en su proceso, cambia el par temperatura y presión, pero su equivalente en entalpía no varía, a esto se le conoce como proceso isoentálpico.
Aplicación del Primer Principio de la Termodinámica a un Sistema Abierto
Cuando tenemos un volumen de control en donde tenemos un flujo de masa que entra, que sale, o ambos, decimos que tenemos un sistema abierto. Además de esto, podemos tener un intercambio de calor con el exterior, y un intercambio de trabajo (por ejemplo, si tuviéramos un rodete girando en su interior).
| Sistema Abierto |
|
ΔE= Q + W + (h_entrada x Masa_entrada)+ (h_salida x Masa_salida) |
|
Donde: ΔE = ΔEc + ΔEp + ΔU, despreciando ΔEc y ΔEp...
|
|
Finalmente, tenemos: ΔU = Q + W + (h_entrada x Masa_entrada)+ (h_salida x Masa_salida) |
Imaginemos entonces que queremos cargar el recipiente hasta que se alcance cierto límite de presión, ¿qué temperatura alcanzará el recipiente?
Descripciones del modelo, condiciones de contorno:
- Por simplicidad inicial no consideraremos intercambio de calor con el exterior.
- En este caso tampoco no hay intercambio de trabajo (el volumen de la botella es constante).
- No hay un flujo de salida, solo de entrada.
Con lo que la temperatura final solo está gobernada por dos términos: la energía interna inicial en el recipiente antes de ser recargada, y la entalpía del gas que entra. Lo que se describe así:
- Energía interna inicial del recipiente: para su evaluación, necesitamos conocer la presión y temperatura del recipiente.
- Entalpía del hidrógeno de entrada: para su evaluación, necesitamos conocer la presión y temperatura a la salida de la válvula, o la salida del compresor/botella.
De esta forma podríamos hallar la temperatura que alcanzaría nuestro recipiente, si alcanza cierta presión. Para la aplicación de este balance, te recomiendo esta calculadora online: Calculadora de Recargas.
¿Y si queremos modelar la cantidad de calor a disipar, para que alcanzado cierto límite de presión, no se supere cierta temperatura?
Esto sería lo más cercano a un caso real, como por ejemplo cuando queremos recargar un autobús a 350 barg, pero tenemos la restricción de que sus depósitos de hidrógeno no pueden alcanzar los 85ºC.
Volviendo a la tabla anterior, ahora solo tendríamos que despejar el calor intercambiado, ya que serían conocidas la temperatura final y presión. Puedes hacer estos cálculos de disipación térmica en esta calculadora online: Potencia Térmica - Recargas de hidrógeno.